「メタボリックシンドロームに対する行動変容アプローチ」
| 鹿児島大学大学院医歯学総合研究科 社会・行動医学講座(心身医療科) 教授 乾 明夫 |
この50年間の日本人の体重の推移を見ると、男女ともに殆んどの年代でカーブは右上がりを示し、日本人は肥満化の一途をたどっていることがわかる(図1A)。Body mass index(BMI)25以上を肥満と考えると、日本人の4人に1人が肥満の範疇に属すると言われるようになった。この原因としては、エネルギーの総摂取量に変化はないが、脂肪摂取の増加と運動不足(エネルギー消費の減少)があげられ、余剰なエネルギーが体脂肪として蓄積されていることになる。飽食、美食の世の中にあっては、この傾向は今後も続き、肥満およびメタボリックシンドロームがますます深刻な問題になると危惧されている。
この例外は若い女性であり、この50年間に体重減少の一途をたどり、4人に1人が痩せの範疇に属することになり、神経性食欲不振症をはじめとする摂食障害の増加が危惧されている。また、過栄養の世代にあっても、食欲不振、悪液質は大きな問題であり、老化や疾患に伴う悪液質、あるいは摂取不足(食料不足)による悪液質も、世界的には大きな問題である。発展途上国においては、肥満と悪液質は共存し、社会に対するdouble burdenとして知られている。
本稿では、(内臓)脂肪蓄積をベースに、軽度の高脂血症、高血圧、耐糖機能障害が集族した病態であるメタボリックシンドローム(図1B)の成因と、行動変容を中心とした治療について述べる。

図1.日本人の体重(BMI)の年次推移(A:1950−2000)とメタボリックシンドロームの診断基準(B)
BMI=kg/m2
2.レプチンの発見と食欲・体重調節機構
1994年のレプチンの発見以来、食欲調節に関する理解に飛躍的な進歩が認められた(図2)1-5)。体脂肪組織からその量に応じて放出されるレプチンは、脳内に体脂肪の蓄積状況を伝える求心性シグナルとして作用し、視床下部に存在する食欲調節物質が食欲やエネルギー消費を変えることにより、体重(体脂肪量)を一定に保持するというフィードバックループの存在が証明された。レプチン発見後も、食欲中枢とされてきた視床下部外側野からオレキシン、メラニン凝集ホルモン(MCH)が、また胃からは空腹物質として、グレリン6,7)が単離、同定された。また、消化管ホルモンペプチドYY(PYY)やグルカゴン様ペプチド1(GLP-1)の、ヒトにおける食欲抑制作用や臨床応用の可能性も、報告されるようになってきた8,9)。
食欲・体重調節ループはこのように、多くの食欲調節ペプチドやアミン、アミノ酸などにより、大変精巧に調節されている系である(図2)。過食や運動不足により体脂肪量が増加すると、血中レプチンは増加し、視床下部弓状核の食欲抑制系(メラノコルチン:MC/コカイン・アンフェタミン調節ペプチド:CART)を活性化させることで、食欲・体重を減少させる。一方、空腹や飢えに際しては、体脂肪量の減少を反映して血中レプチンは低下、グレリンは増加し、視床下部弓状核の食欲促進系(神経ペプチドY:NPY/アグーチ関連ペプチド:AgRP)を活性化させ、食欲・体重を増加させる。
しかしながら、こういったレプチンの食欲、体重抑制作用が作動しない状態−レプチン抵抗性が、肥満病態に共通して認められることも明らかとなった。このことは、飢えとともに歩んできた人類の長い進化の歴史を考慮すると、食欲・体重調節機構の本態は肥満の制御にあるのではなく、むしろ飢えに応答10-12)することにあると理解されるようになった(倹約遺伝子仮説)。すなわち、進化の過程で獲得したことは、いかに体脂肪を蓄積するかということにあり、その結果、脂肪組織より放出されるアディポサイトカインの量的、質的変動を生じ、インスリン抵抗性、高血圧、血栓形成傾向や動脈硬化を招来すると考えられている(図3)。
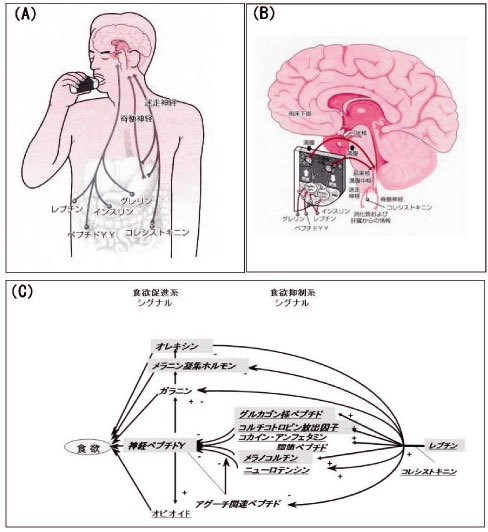
図2.視床下部に働く食欲調節因子と食欲調節カスケード
(A)胃が空虚になるとグレリン分泌は促進し、食欲が生じ、摂食行動が開始される。摂食後にはコレシストキニン(CCK)やペプチドYY(PYY)などの満腹ホルモンが増加し、食欲は抑制され、摂食行動は停止する。1回1回の食事量の総和は体脂肪量の増減となり、体脂肪量に応じて血中に放出されるレプチンが、長期にわたる体脂肪量の調節を行う。(B)レプチンやグレリンは、液性及び神経性にその情報を中枢神経系に伝え、視床下部の強力な食欲促進系−神経ペプチドY(NPY)/ アグーチ関連ペプチド(AgRP)、および食欲抑制系−メラノコルチン(POMC)/ コカイン・アンフェタミン調節ペプチド(CART)に相反する作用を営む。すなわち、レプチン低下 / グレリンの増加(体脂肪量の低下)は食欲促進系(NPY / AgRP)を活性化させ、レプチンの増加 / グレリンの低下(体脂肪量の増加)は食欲抑制系(POMC / CART)を活性化させる。レプチンは視床下部弓状核(ARC)にある受容体に結合後、JAK-STAT系及び一部IRS−PI(3)kinase系を活性化させ、そのシグナルは室傍核(PVN)などに伝えられ、食欲抑制、エネルギー消費促進作用が発現される。しかし、進化の長い歴史にあっては、この調節系は主としてエネルギーの備蓄に関わったという。(C)図中斜体下線は食欲・体脂肪量抑制シグナルを、斜体は食欲・体脂肪量促進シグナルを示す。網目部分は、薬理学的検討や遺伝子組み換えマウスを用いた成績から、体重調節への作用が明確に示されたものを示す。カスケードの流れは一方向ではなく、例えば神経ペプチドYからメラノコルチン系への抑制が、その食欲促進作用に重要である。
(4),(13)より改変引用
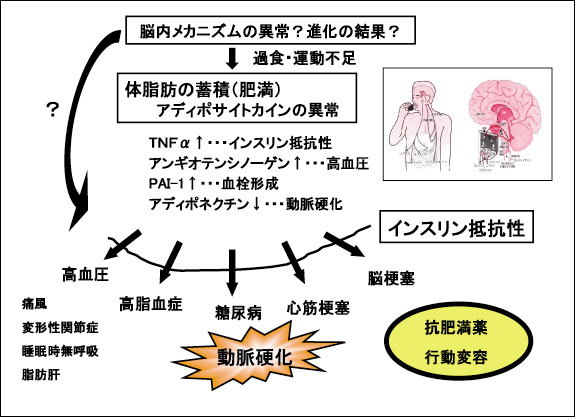
図3.メタボリックシンドロームの発生機序(乾)
3.体重の‘セットポイント’を考慮した減量計画
そうであれば、肥満の治療には困難を伴うことが予想される。事実、肥満は生じやすいが、減量にはリバウンドを伴うことが多い。100kgの体重を90kgにするだけで、エネルギー消費は抑制され、なおあまりある体脂肪量にもかかわらず、生体は飢えに対する応答を行う(図4)。このことは、高度肥満のみならず、メタボリックシンドロームの治療のために、軽度の減量を行う場合も同様であり、リバウンドの根底をなすと考えられる。
個々人の体重は、ちょうど体温のように、正常ではごく狭い範囲内で一定に保たれているが、これは体重が脳内でセットされているためであると考えられている。100kgの体重を3ヶ月かけて90kgに減量すると、なお余りある体脂肪量にもかかわらず、生体はエネルギー消費を抑制し、おそらくはその利用効率を高め、体重を増加させようとする。すなわち、生体は脳内にセットされた100kgの体重に戻すように応答し、これが進化の過程で獲得されてきた機序であり、リバウンドの根底をなすと考えられる。しかし、この100kgのセットは決して永続するものではなく、経験的に3〜6ヶ月90kgの体重を維持すると、エネルギー消費は上昇し、減量に無理のない状態、すなわちセットポイントが90kgに移行した状態となり、再度減量をすすめることが可能となる(図4)。したがって、減量過程ではなく、減量体重維持過程に全力を注ぐべきこととなる。
最初の減量は、無理なく進めたい。可能な範囲から、まずは摂取エネルギーを減少させる。1日300kcalの減量を1ヶ月続け、約1kgの減量(脂肪量減少)が達成されるので、エネルギーが1g=9kcalの脂肪の摂取を制限することになる。動物実験では、脂肪摂取に依存が生じるといわれている。調理法では“煮物”,“炒め物”を避け,“むす”,“焼く”,“ゆでる”に変更する。フードピラミッドを利用し、自分の食習慣がピラミッド型か逆ピラミッド型(欧米型食生活)かを確認する。ピラミッドの底部には炭水化物、野菜、果物、中段には魚、豆、牛乳、そして頂部には肉、卵、油、ケーキなど摂取を制限すべき品目を置く。視覚に訴えることは重要であり、グラフ化体重日記なども併用する(図4)。
2〜3kgの減量が得られると、膝関節にかかる荷重は随分と軽くなるので、ここで運動療法を開始する。減少したエネルギー消費を上昇させる目的や、食後高血糖を是正(筋肉への取り込みを促進)させる目的から好都合である。空腹状態で運動することは難しいので、低カロリー食品をふんだんに取り入れ、満腹感を維持しておく。制限はできるだけ少なくする。制限されればされるほど、その渇望が強くなるからである。β3アドレナリン受容体遺伝子多型なども、髪の毛1本から検出される時代になったので、希望者には動機付けを高める意味からも測定する。ホモの異常例(Trp64Arg変異)では、200kcal/日のエネルギー節約が可能と報告され、これは1ヶ月あたり1kgに近いエネルギーの節約となる。可能であるならば、酸素消費量や体組成分析を行って、筋肉量を評価しておきたい。
チーム医療が組めるようであれば、栄養士、運動療法士や臨床心理士を加える。治療は個別に行うのが原則である。運動療法は、その導入にも維持にも工夫が必要であり、瞑想、ストレッチ、ヨガ、リラクゼーションや音楽療法なども組み合わせる。行動療法としては自己モニタリング、刺激統制(例えば、空腹下で買い物に行かない、何軒ものお店に立ち寄らない)、オペラント強化(減量が進んだ時、あるいは減量ができないがきちんと受診ができた時の褒め言葉やデータの改善)や集団療法も効果的である。食がストレスの代償行動となっている場合には、十分なカウンセリングや家族の調整なども行い、別枠に扱う必要がある。インターネットや双方向テレビ、あるいは電話をかけたり、資料を送ったりといったフォローアップ(介入)が重要である。

図4.食事療法のトランスセオレティカル・モデル(A)とセットポイント仮説(B)
トランスセオレティカル・モデルは、望ましい行動の発現や継続を妨げる要因の除去と動機付けに主眼がおかれる、個別のアプローチである。変容ステージ(例えば食事や運動について)を
1.前熟考ステージ ― 行っていない。近い将来に、始めるつもりはない
2.熟考ステージ ― 行っていない。しかし、6ヶ月以内に行おうと思っている
3.準備ステージ ― すぐに始めるつもりである。または、自分なりにやっている
4.実行ステージ ― 行っている。始めて6ヶ月以内である
5.維持ステージ ― 行っている。6ヶ月を越えている
に分類し、それぞれのステージに応じた変容プロセスを行う。この際、生物学的なリバウンド(セットポイント仮説)を常に考慮する必要がある。行動変容には、フードピラミッドやグラフ化体重日記など、視覚に訴える手段も効果的である(C)。フードピラミッドとして、我々が行ってきた1単位=100kcalの食事療法を例に挙げた。
4.行動変容のアプローチ
現在、多くの抗肥満薬が開発され、わが国でも臨床試験が行われつつある。中枢ニューロンにおけるセロトニンおよびノルアドレナリン再取り込み阻害薬のシブトラミン、大麻成分でもあるカンナビノイドの受容体拮抗薬リモナバンやリパーゼ阻害薬などである。しかし、多くの薬剤の臨床効果(最大減量効果)は半年から一年程度であり、薬剤継続投与にもかかわらず体重増加が認められる事実は、食欲制御の難しさを示している。
行動変容のための具体的手段のいくつかは前述したが、行動変容の目標は、患者の治療的主体性を高め、治療動機水準を強化し、減量とその長期維持を可能にすることにおかれている(肥満症治療ガイドライン2006、日本肥満学会)。肥満学会では、
①セルフモニタリング―食事、運動、体重などの自己記録とフィードバック
②ストレス管理―ストレスと食の関係およびその対処法
③先行刺激のコントロール―食の誘発因子の同定(ながら食い、グルメ番組など)
④問題点の抽出と解決―減量阻害要因の同定と解決
⑤修復行動の報酬による強化―ほめ言葉やデータ上の改善
⑥認知の再構築―非現実的な食行動の気付きの修復(目の前の食べ物は全部食べないと落ち着かないなど)
⑦社会的サポート―家族、友人、職場での励ましやグループ療法
の7項目を治療上のポイントとしてあげている。
メタボリックシンドロームに対して、どのような行動療法や健康行動介入プログラムが適切であるのかは、今後に残された課題である。メタボリックシンドロームに対するヘルスプロモーション活動は、その発症や増悪の防止を考慮すると、国民・社会のレベル(上流アプローチ)で、地域・学校・職場のレベル(中流アプローチ)で、そして個人のレベル(下流アプローチ)で行われる必要があろう。個人に焦点を絞った介入としては、トランスセオレティカル・モデルを用いた食事療法や運動療法などが試みられつつある(図4)。個人個人の嗜好や考え、性格などに応じて、個別で画一的でない行動変容のアプローチがとられるべきであろう。医師以外に、看護師、栄養士、薬剤師、運動療法士など、広くコメディカルスタッフが担当することが可能である点に注目すべきである。
5.おわりに
メタボリックシンドロームの予防や治療は、糖尿病学会や循環器病学会など、単一の医学・医療分野からのアプローチだけでは不十分である。メタボリックシンドロームが脂肪蓄積病態をその根底とする以上、食欲・体重調節に対する生物学的理解と、それをベースにした予防、治療に向けての行動変容アプローチの構築が必須である。行動医学に付託された部分は大きく、医師会は連携医療の中で、その中心的な位置を占めることになろう。
参考文献
1) Zhang Y, Proenca R, Maffei M, et al. Positional cloning of the mouse obese gene and its human homologue. Nature 1994; 124: 188-198
2) Farooqi IS, Jebb SA, Lanqmack G, et al. Effects of recombinant leptin therapy in a child with congenital leptin deficiency. N Engl J Med 1999; 341: 879-884
3) Kalra SP, Dube MG, Pu S, et al. Interacting appetite-regulating pathways in the hypothalamic regulation of body weight. Endocr rev 1999; 20: 68-100
4) Inui A. Transgenic approach to the study of body weight regulation. Pharmacol Rev 2000; 52(1):35-61
5) Morton GJ, Cummings DE, Baskin DG, et al. Central nervous system control of food intake and body weight. Nature 2006; 443(7109): 289-295
6) Kojima M, Hosoda H, Date Y, et al. Ghrelin is a growth-hormone-releasing acylated peptide from stomach. Nature 1999; 402: 656-660
7) Inui A. Ghrelin : an orexigenic and somatotrophic signal from the stomach. Nat Rev Neurosci 2001; 2(8):551-560
8) Batterham RL, Cowley MA, Small CJ, et al. Gut hormone PYY(3-36)physiologically inhibits food intake. Nature 2002; 418: 650-654
9) Inui A. Neuropeptide gene polymorphisms and human behavioural disorders. Nat Rev Drug Discov 2003; 2: 986-998
10) Inui A. Cytokines and sickness behavior: implications from knockout animal models. Trends Immunol 2001; 22(9): 469-473
11) Inui A. Eating behavior in anorexia nervosa−An excess of both orexigenic and anorexigenic signaling? Mol Psychiatry 2001; 6(6): 620-624
12) Inui A: Cancer anorexia-cachexia syndrome: Current issues in research and management. CA Cancer J Clin 2002; 52(2): 72-91
13) Marx J. Cellular warriors at the battle of the bulge. Science 2003; 299(7): 846-849
(C)Kagoshima City Medical Association 2009